Hvordan rapportere en alvorlig hendelse
Publisert:
|
Oppdatert:
Endringer
Produsenter skal rapportere alvorlige hendelser umiddelbart etter det er fastslått en årsakssammenheng mellom hendelsen og utstyret, eller at en slik årsakssammenheng er rimelig å anta.
Innhold på siden
Inntil den europeiske databasen for medisinsk utstyr, Eudamed, er fullt operativ, skal den alvorlige hendelsen kun rapporteres i landet der hendelsen skjedde. Rapporten skal sendes til landets kompetente myndighet, som i Norge er Direktoratet for medisinske produkter.
Tidsfrister
Fristen gjelder fra den dato produsent ble kjent med hendelsen til rapport sendes til myndighetene.
Er det usikkert om hendelsen man sitter med er rapportpliktig til myndighetene, skal det likevel rapporteres innen tidsfristene.
| Klassifisering av hendelse | Tidsfrist |
|---|---|
| Alvorlig trussel mot folkehelsen | 2 dager |
| Dødsfall | 10 dager |
| Uventet alvorlig forverring av en persons helsetilstand | 10 dager |
| Andre alvorlige hendelser | 15 dager |
Om produsent har alle opplysninger som er nødvendig for å konkludere innenfor tidsfristene kan rapporten sendes som en kombinert foreløpig og endelig rapport (kombinert rapport). Om det ikke er mulig å avgjøre om en hendelse er rapportpliktig, skal den rapporteres innen fristene. Produsent kan da velge å framlegge en foreløpig, men ufullstendig rapport og deretter følge opp med en fullstendig rapport når de har innhentet all nødvendig informasjon og har ferdigstilt utredningen.
Skjema
For rapportering til myndighetene skal det benyttes felleseuropeisk rapportskjema, Manufacturer incident report (MIR).
Manufacturer incident report (MIR) Version 7.2.1
Ved innsending av foreløpig rapport vil DMP svare med sitt saksnummer. Denne skal tydelig fremkomme i all videre kommunikasjon.
For mer info om de forskjellige feltene, se støttedokumentet MIR helptext.
Det utfylte rapporteringsskjemaet sendes til:
Både PDF og XML versjon av rapporten skal vedlegges.
Støttedokumenter
Meldinger om alvorlige hendelser kan føre til at produsent må igangsette et korrigerende sikkerhetstiltak.
Meldeplikt for helsevirksomheter
Helsevirksomheter har meldeplikt om alvorlige hendelser som har eller kan ha sammenheng med bruk av medisinsk utstyr.
Meld en alvorlig hendelse på Melde.no
Alvorlige hendelser og korrigerende sikkerhetstiltak for helsevirksomheter
Privatpersoner
Om du som privatperson opplever en alvorlig hendelse oppfordres det til å oppsøke behandler, distributør eller andre hvor du fikk tilgang til det aktuelle utstyret. Disse har da en plikt til å melde videre.
Oversikt over de ulike rollene for markedsdeltakere
| Markedsdeltaker | Definisjon i MDR artikkel 2 og IVDR artikkel 2 |
|---|---|
| Produsent | en fysisk eller juridisk person som framstiller eller helrenoverer utstyr, eller som får utstyr designet, framstilt eller helrenovert, og som markedsfører nevnte utstyr i eget navn eller under eget varemerke. |
| Autorisert representant | enhver fysisk eller juridisk person etablert i Unionen* som har fått og har akseptert en skriftlig fullmakt fra en produsent plassert utenfor Unionen, til å utføre bestemte oppgaver på dennes vegne med hensyn til dennes forpliktelser i henhold til denne forordning. |
| Importør | enhver fysisk eller juridisk person etablert i Unionen* som bringer utstyr fra en tredjestat i omsetning i Unionen*. |
| Distributør | enhver fysisk eller juridisk person i omsetningskjeden, utenom produsenten eller importøren, som gjør utstyr tilgjengelig på markedet fram til ibruktaking. |
| Helseinstitusjon | en organisasjon som har som hovedformål å pleie eller behandle pasienter eller fremme folkehelsen. |
* Med «Unionen» menes her EU/EØS-området og Tyrkia.
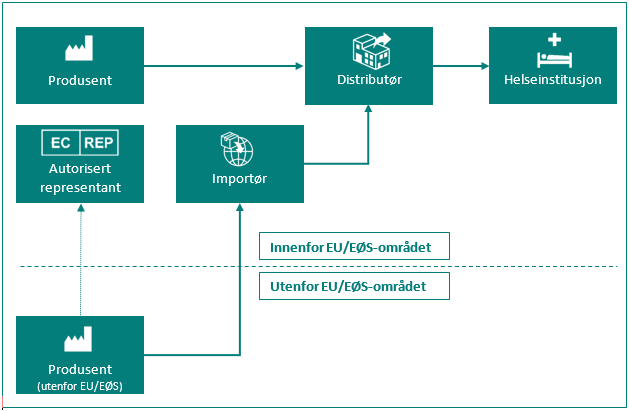
Figur: Markedsdeltaker i omsetningskjeden.