Opplæringsmateriell - veiledning for innsending og distribusjon
Publisert:
|
Oppdatert:
Endringer
- : Lagt til informasjon om distribusjon av opplæringsmateriell for legemidler som ikke er markedsført i Norge
- : Avsnittet "Opplæringsmateriell for legemidler som ikke er markedsført i Norge" er oppdatert
- : Informasjon om Markedsførte legemidler som får krav om opplæringsmateriell er blitt flyttet ut som et eget avsnitt. Spesifisert når 30 dagers fristen gjelder fra og at opplæringsmateriellet også skal være distribuert innen det.
- : Lagt til avsnitt "Opplæringsmateriell for legemidler som ikke er markedsført i Norge"
- : Lagt til avsnitt "Oppdatering etter GVP modul XVI Rev. 3"
- : Online kurs er fjernet
- : Lagt til tekst om at MT-innehaver for generisk produkt må sikre at helsepersonell er klar over at det finnes opplæringsmateriell for deres produkt ved å sende ut e-post eller brev. Det må informeres om at materiell kan bestilles fysisk fra MT-innehaver
- : Oppdatert regler om versjonsnummer og dato
- : Lagt til avsnitt "Tittel, produktnavn og kontaktinformasjon" og "Pasientkort"
- : Fjernet tekst om unntak for svart trekant på pasientkort
- : Oppdatert regler om bruk av firmalogo
- : Lagt til punkt "henvisning til regulatorisk prosedyre som har ført til krav om opplæringsmateriell" under "Før bruk og distribusjon skal følgende sendes inn".
- : Sjekklisten er oppdatert i henhold til ny GVP modul. Den har også fått riktig grafisk profil.
- : Figur om når MT-innehaver skal sende inn opplæringsmateriell har blitt oppdatert i henhold til ny grafisk profil
- : Tekst om innsending av opplæringsmateriell til reseptfrie legemidler med veiledning har blitt fjernet.
- : Hele teksten er gjennomgått og det har blitt gjort en del omformuleringer for å bedre språk og forståelse
- : Endret lenke til GVP Module XVI- Risk minimisation measures pga. ny revidert versjon. Slettet lenke til GVP Module XVI Addendum I- Educational materials ettersom denne er utdatert og ny versjon inngår i GVP Module XVI- Risk minimisation measures (Rev 3)
- : Endret anbefaling av distribusjon av opplæringsmateriell for generiske legemidler
Noen legemidler har risiko for særskilte bivirkninger og da kan produsent bli pålagt å lage opplæringsmateriell til helsepersonell, pasienter og/eller pårørende. Formålet med dette materiellet er å redusere risikoen for at disse bivirkningene skal oppstå.
Innhold på siden
Opplæringsmateriell er et risikominimeringstiltak (additional risk minimisation measures) og kan være et krav i markedsføringstillatelsen til legemiddelet. For legemidler i sentral prosedyre gis kravene i SmPC Annex II, for øvrige prosedyrer beskrives de i risikohåndteringsplanen (RMP).
For å få oversikt over når MT-innehaver skal sende inn opplæringsmateriell til DMP kan denne figuren brukes:
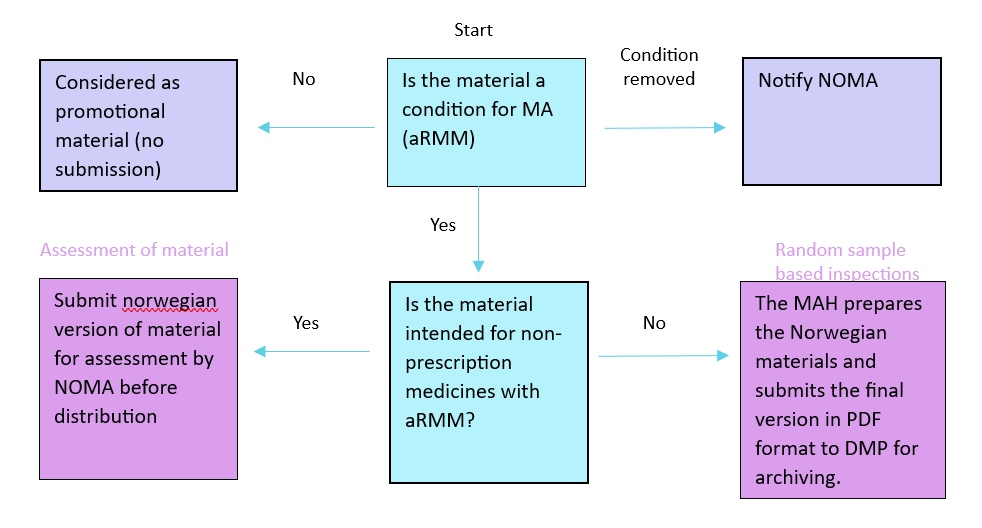
Innsendelse av opplæringsmateriell
Opplæringsmateriell med stikkprøvebasert tilsyn
I november 2020 innførte DMP stikkprøvebasert tilsyn av opplæringsmateriell. Ordningen innebærer at MT-innehaver skal sende inn endelige norske versjoner av opplæringsmateriellet før distribusjon. DMP vurderer ikke materiellet før bruk. Materiellet blir arkivert internt og DMP fører stikkprøvebasert tilsyn. Tilsynet gjøres for å sikre at opplæringsmateriell er i tråd med anbefalinger fra EMA og våre nasjonale retningslinjer. Når et opplæringsmateriell blir trukket ut i stikkprøvebasert tilsyn vil MT-innehaver få en tilbakemelding etter vurdering.
Det finnes en sjekkliste og en ordliste som kan brukes under arbeidet med opplæringsmateriell.
Før bruk og distribusjon skal følgende sendes inn:
-
endelige norske PDF-versjoner av materiell med endelig layout (og ev. følgebrev)
-
nyeste versjon av risikohåndteringsplan del V (RMP). For legemidler godkjent i sentral prosedyre kan alternativt Annex IID til SmPC sendes
- henvisning til regulatorisk prosedyre som har ført til krav om opplæringsmateriell
-
mottakergrupper (MT-innehaver bestemmer mottakergrupper selv)
-
hvordan materiell skal distribueres inklusiv tidsplan for distribusjon
Ved oppdatering av materiell sendes i tillegg:
-
begrunnelse for oppdatering av materiell
Materiellet sendes til opplaeringsmateriell@dmp.no eller educationalmaterial@noma.no
Oppdatering etter GVP modul XVI Rev.3
I august 2024 ble GVP modul XVI versjon 2, erstattet av XVI versjon 3. I etterkant av dette har DMP oppdatert veiledningen «Opplæringsmateriell- veiledning for innsending og distribusjon». Oppdateringene som er gjort inkluderer endringer basert på ny versjon av GVP XVI (Rev. 3). I tillegg har DMP hatt en gjennomgang og oppdatering av nasjonale krav og anbefalinger.
Oppdatert veiledning gjelder for nye opplæringsmateriell utarbeidet etter versjon 3 av GVP modul XVI ble publisert. MT-innehaver trenger ikke å oppdatere eksisterende opplæringsmateriell kun for å følge den nye veiledningen. Når MT-innehaver må oppdatere eksisterende opplæringsmateriellet av andre årsaker, bør materiellet også oppdateres til å følge den nye veiledningen.
Veiledninger
Veiledning for utarbeidelse av opplæringsmateriell:
EMAs overordnede beskrivelse om ulike risikominimeringstiltak og opplæringsmateriell: Guideline on good pharmacovigilance practices (GVP) Module XVI– Risk minimisation measures (Rev 3)
Sjekkliste for utforming av opplæringsmateriell
Følg ellers de nasjonale retningslinjene på denne nettsiden.
Språk og tekst
Opplæringsmateriellet skal være på norsk. Det skal ha tydelig og klart språk, uten tunge og kompliserte setninger. Hvis språket er av dårlig kvalitet eller uforståelig, vil MT-innehaver bli bedt om å forbedre språket ved stikkprøvebasert tilsyn.
Alle punktene beskrevet i RMP del V/SmPC Annex IID skal omtales.
Unødvendig tekst i opplæringsmateriell bør unngås, siden hensikten med opplæringsmateriell er å beskrive utvalgte risikoer ved bruk av legemiddelet.
Eksempler på unødvendig tekst er beskrivelse av virkningsmekanismer, sykdomslære og lignende.
Farge-, billed- og logobruk
Opplæringsmateriell skal ikke inneholde farger som er kommersielt relatert, det vil si farger som er relatert til markedsføring av produktet. Det er imidlertid lov å bruke firmaets farger i materiellet.
MT-innehaver skal som hovedregel unngå bruk av firmalogo og produktlogo i materiellet. Dersom MT-innehaver mener det er hensiktsmessig med logo, må de begrunne hvorfor den er tatt med. Logoen skal i så fall være kun ett sted i materiellet, og skal ikke være større enn overskriftens skriftstørrelse.
Opplæringsmateriellet skal ikke inneholde bilder eller illustrasjoner med mindre dette bidrar til økt forståelse av innholdet, for eksempel en bestemt prosedyre, ulike injeksjonssteder, teknikker for administrering eller lignende.
Fargebruk må ikke bidra til dårlig lesbarhet ved redusert kontrast.
Signatur fra forskriver/pasient
Opplæringsmateriell skal ikke inneholde signaturlinje eller krav til signatur fra forskriver og/eller pasient, med mindre dette er vedtatt av EMA/Kommisjonen. Signaturfelt kan gi feilaktig inntrykk av at det følger med ekstra forpliktelser for pasient eller helsepersonell som signerer.
Dette er ikke til hinder for at kontaktopplysninger til behandlende lege/klinikk og annet kan påføres pasientmaterialet når hensikten er å informere annet helsepersonell om kontaktopplysninger ved en krisesituasjon for pasienten.
Versjonsnummer
Opplæringsmateriellet må ha versjonsnummer og dato for innsending i format <mnd><år>, minimum på første og/eller siste side, men fortrinnsvis på alle sider.
Følgebrev
Det anbefales at MT-innehaver legger ved et følgebrev ved distribusjon som forklarer hensikten med opplæringsmateriellet eller endringer i dette. MT-innehaver skal merke følgebrevet med DMPs standardlogo for sikkerhetsinformasjon, se avsnitt under.
Tittel, produktnavn og kontaktinformasjon
Tittelen på opplæringsmateriellet skal informere om type opplæringsmateriell, for eksempel om det er veileder for helsepersonell eller pasienter. Den skal også inneholde produktnavn med virkestoffnavn i parantes bak. I resten av opplæringsmateriellet skal produktnavn brukes så få ganger som mulig.
Kontaktinformasjon til MT-innehaver skal stå i opplæringsmateriellet, for eksempel e-postadresse eller telefonnummer.
Sikkerhetsinformasjonslogo
DMPs sikkerhetsinformasjonslogo for opplæringsmateriell er et nasjonalt krav. Logoen skal være på opplæringsmateriell, følgebrev og konvolutter, slik at helsepersonell og pasienter kan skille opplæringsmateriell og reklamemateriell. På pasientkort skal MT-innehaver vurdere om det er plass til sikkerhetsinformasjonslogoen.
Vær oppmerksom på at sikkerhetsinformasjonslogoen for opplæringsmateriell er annerledes enn sikkerhetsinformasjonslogoen for Kjære helsepersonell-brev.
Standardtekster
Melding av bivirkninger
Opplæringsmateriell skal inneholde tekst hvor det oppfordres til å melde bivirkninger. På pasientkort skal MT-innehaver vurdere om det er plass. Følgende standardsetninger bør brukes:
Tekst til materiell til helsepersonell
-
Helsepersonell bes melde nye, uventede og alvorlige mistenkte bivirkninger på elektronisk meldeskjema:
Tekst til materiell til pasienter
-
Bivirkninger kan meldes på elektronisk skjema til DMP:
For legemidler med svart trekant finnes egne standardtekster.
Standardsetning om hvor materiell kan finnes på nett
Det skal fremgå av opplæringsmateriell og følgebrev, hvor opplæringsmateriellet, pakningsvedlegg og preparatomtalen kan finnes på nettet. Følgende standardsetning kan brukes:
Se oppdatert pakningsvedlegg, preparatomtale (SmPC) og opplæringsmateriell på www.felleskatalogen.no.
Svart trekant
Opplæringsmateriell for legemidler som står oppført på felles europeisk overvåkingsliste skal inneholde svart trekant foran preparatnavnet (▼preparatnavn), i begynnelsen av opplæringsmateriellet. Trekanten skal ha samme høyde som bokstavene i preparatnavnet den står foran. På samme side bør det være en forklarende tekst om svart trekant (se GVP modul X C.3.5 for detaljer).
Forklarende tekst om svart trekant til:
Helsepersonell:
-
Dette legemiddelet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Helsepersonell oppfordres til å melde enhver mistenkt bivirkning på elektronisk meldeskjema:
Pasienter:
-
Dette legemiddelet er underlagt særlig overvåking for å oppdage ny sikkerhetsinformasjon så raskt som mulig. Du kan bidra ved å melde enhver mistenkt bivirkning:
Pasientkort
For krav til utforming av pasientkort se GVP Modul XVI.App2.4. Patient card.
Når det gjelder sikkerhetsinformasjonslogo og standardtekst om melding av bivirkninger skal MT-innehaver vurdere om det er plass på pasientkortet.
Svart trekant bør være med på pasientkortet (GVP modul X C.3.5).
Distribusjon
MT-innehaver skal alltid sende DMP et forslag til hvordan materiell skal distribueres/tilgjengeliggjøres. Samtidig skal det foreslås tidsplan for publisering og/eller distribusjon. Nytt opplæringsmateriell skal som hovedregel distribueres til valgte mottakergrupper, i tillegg oppfordrer vi til at materiellet tilgjengeliggjøres på Felleskatalogen. Dette gjelder også ved betydningsfulle endringer i eksisterende opplæringsmateriell. Ved mindre endringer kan det vurderes kun å publisere på Felleskatalogen.
Opplæringsmateriell for generiske legemidler distribueres som hovedregel ikke. Originalprodusent har som regel distribuert opplæringsmateriellet tidligere. MT-innehavere for generiske legemidler, må sikre at helsepersonell er klar over at det finnes opplæringsmateriell for deres produkt ved å sende ut e-post eller brev. Det må informeres om at materiellet kan bestilles fysisk fra MT-innehaver.
Apotek
Opplæringsmateriell til apotek sendes på epost. Oversikt over epostadresser til apotekene fås fra Felleskatalogen. For å få utlevert listene sendes en epost til redaksjonen@felleskatalogen.no med emnefeltet "E-post apotek til utsendelse av opplæringsmateriell".
Eposten til apoteket bør inneholde teksten "Sikkerhetsinformasjon etter krav fra DMP" i emnefeltet. Opplæringsmateriellet legges ved eposten i PDF-format.
Fastleger/allmennleger
Opplæringsmateriell skal ikke sendes til fastleger på papir. DMP formidler isteden informasjonen via varsler i pasientjournalen (EPJ).
Fastlegene varsles utelukkende om oppdatert materiell hvis oppdateringen er pålagt av myndigheter. Det er derfor viktig at det tydelig fremgår i innsendelse til DMP om oppdateringen er pålagt. Det må i tillegg fremgå tydelig at fastleger er mottakergruppe for materiellet.
Øvrige leger/annet helsepersonell
Opplæringsmateriell til øvrige grupper av leger/helsepersonell sendes per post.
Publisering hos Felleskatalogen
Vi oppfordrer på det sterkeste til å publisere alt opplæringsmateriell på Felleskatalogen. Grunnen til dette er at Felleskatalogen brukes av nær sagt alt helsepersonell og det er større sannsynlighet for at opplæringsmateriellet blir brukt hvis det er lett tilgjengelig. Det vil øke pasientsikkerheten hvis alt opplæringsmateriell er tilgjengelig for helsepersonell og pasienter via Felleskatalogen.
Det finnes tre kategorier for å laste opp opplæringsmateriell på Felleskatalogen:
- Opplæringsmateriell og veiledning ved bruk
- Graviditetsforebyggende program
- Opplæringsmateriell og graviditetsforebyggende program
Felleskatalogen sorterer materiell i korrekt kategori når materiell er innsendt til Felleskatalogen.
- Opplæringsmateriell (RMP-materiell) publiseres på www.felleskatalogen.no
- Bruk FK SHARE for opplasting, https://share.felleskatalogen.no/
- Er du ny FK SHARE-bruker? Send e-post til redaksjonen@felleskatalogen.no for å bli registrert
NB! RMP-materiell skal alltid merkes med ‘RMP’ i filnavnet. Siden RMP-materiell er etter krav fra DMP, vil Felleskatalogens redaksjon ikke vurdere dette materiellet ytterligere.
Markedsførte legemidler som får krav om opplæringsmateriell
For legemidler som allerede er markedsført, har MT-innehaver en frist på 30 dager til å sende inn og distribuere opplæringsmateriellet etter at kravet om opplæringsmateriell er satt. Fristen på 30 dager gjelder fra positiv opinion i CHMP og gjelder kun for legemidler som ikke har opplæringsmateriell fra før.
Opplæringsmateriell for generiske/biotilsvarende legemidler
Der betingelsene for generiske/biotilsvarende produkter er identiske med originalproduktet, bør opplæringsmateriellet harmoniseres og følge det eksisterende materiellet for originalproduktet.
For distribusjon av opplæringsmateriell for generiske produkter, se avsnitt om distribusjon over.
Felles utarbeidelse og distribusjon
MT-innehavere for ulike produkter med samme virkestoff og identiske vilkår oppfordres til å samarbeide om utarbeidelsen av opplæringsmateriellet. MT-innehaverne bør sende inn ett felles forslag til opplæringsmateriell til DMP. Vi anbefaler også at MT-innehaverne samarbeider om distribusjon, for å sikre at mottakerne på distribusjonslisten får samme materiell.
Opplæringsmateriell for legemidler som ikke er markedsført i Norge
For legemidler som ikke er markedsført i Norge, vil det som regel ikke være nødvendig å distribuere opplæringsmateriellet i Norge. Hovedregelen er at opplæringsmateriellet kun skal distribueres etter forespørsel fra helsepersonell eller andre brukere av opplæringsmateriellet.
Som beskrevet i GVP modul XVI bør behovet for distribusjon av opplæringsmateriell likevel diskuteres med nasjonal myndighet. DMP ønsker derfor at MT-innehaver tar kontakt dersom de har kjennskap til at et legemiddel som ikke er markedsført i Norge, likevel forskrives her. Distribusjon av opplæringsmateriell kan for eksempel være nødvendig for legemidler hyppig forskrives på godkjenningsfritak eller i enkelte tilfeller ved avregistrering av legemidler. Det er ikke mulig å gi en uttømmende liste over situasjoner det er aktuelt med opplæringsmateriell for legemidler som ikke er markedsført i Norge. MT-innehaver må derfor gjøre en selvstendig vurdering og kontakte DMP for rådgivning i konkrete saker, når de har kjennskap til forskrivning. Henvendelser sendes til opplaeringsmateriell@dmp.no.
DMPs sikkerhetsinformasjonslogo skal som hovedregel ikke tas med på opplæringsmateriell for legemidler som ikke er markedsført i Norge. En engelsk versjon av opplæringsmateriellet vil som oftest være akseptabel når målgruppen er helsepersonell og legemiddelet ikke er markedsført i Norge. Men i enkelte tilfeller kan DMP vurdere at en norsk oversettelse av opplæringsmateriellet er nødvendig.
Distribusjon
Dersom opplæringsmateriell distribueres av MT-innehaver på forespørsel fra brukere, skal det utsendte opplæringsmateriellet også sendes til DMP for arkivering. I henvendelsen skal det spesifiseres at legemiddelet ikke er markedsført i Norge.
Dersom MT-innehaver har kjennskap til forskrivning av et legemiddel med opplæringsmateriell som ikke er markedsført i Norge, skal DMP kontaktes for å avklare om en generell distribusjon eller publisering av opplæringsmateriellet er nødvendig. MT-innehaver kan bli bedt om å publisere opplæringsmateriellet på en fast side på firmaets nettsider eller på Felleskatalogen. Det kan også være aktuelt med utsendelse per post eller e-post. Dersom det ikke er planer om å markedsføre legemiddelet i nærmeste fremtid må MT-innehaver legge ved SmPCen i distribusjonen eller henvise til EMAs nettsider hvor SmPCen kan finnes.
Onlinekurs
Onlinekurset som tidligere var tilgjengelig ble utdatert på grunn av oppdatert versjon av GVP modul XVI. Onlinekurset er derfor fjernet. Det er under vurdering om det skal lages nye videoer og om kurset skal videreføres.