Maksimalpris
Publisert:
|
Oppdatert:
Endringer
Oversikt over maksimalpriser på legemidler, informasjon om revurdering av priser, revurderingsrekkefølge og informasjon om fastsettelse av prisene.
Innhold på siden
Fastsettelse av maksimalpris
Alle registrerte, reseptpliktige legemidler for mennesker må få en maksimalpris, fastsatt av DMP, før de kan markedsføres. Legemiddelfirmaene må derfor søke om pris hos DMP. DMP fastsetter apotekenes maksimale innkjøpspris (AIP) og maksimale apotekavanse. Sammen gir dette apotekenes maksimale utsalgspris (AUP).
Den maksimale tillatte prisen for et legemiddel, vil som regel bli satt lik gjennomsnittet av de tre laveste prisene legemiddelet selges for i et utvalg av europeiske land. Disse landene er Sverige, Finland, Danmark, Tyskland, Storbritannia, Nederland, Østerrike, Belgia og Irland.
I omregningen fra utenlandske til norske priser, benytter vi den gjennomsnittlige valutakursen fra de seks foregående månedene, slik denne presenteres av Norges Bank.
Retningslinjer for prisfastsettelse
Regler for fastsettelse, kontroll og justering av priser på legemidler er beskrevet i legemiddelforskriftens kapittel 12. Direktoratet for medisinske produkter gir i det følgende nærmere retningslinjer for prisfastsettelsen.
Ved prisfastsettelsen vil DMP i størst mulig utstrekning følge hovedreglene, men i enkelte tilfeller vil det være hensiktsmessig å avvike fra disse. DMP vil tilstrebe størst mulig grad av likebehandling når vi vurderer individuelle saker.
Internasjonale prissammenligninger
Det følger av forskrift om legemidler § 12-2 at det skal legges stor vekt på prisen i andre EØS-land ved fastsetting pris på legemidler. Prisen på et reseptpliktig legemiddel i Norge fastsettes som hovedregel lik gjennomsnittet av de tre laveste markedsprisene på legemiddelet i et nærmere utvalg av land.
Referanselandene som inngår i prissammenligningen er: Sverige, Finland, Danmark, Tyskland, Storbritannia, Nederland, Østerrike, Belgia og Irland. Dersom det finnes markedspris i kun 3 eller færre av referanselandene, fastsettes maksimalprisen lik gjennomsnittet av disse prisene.
Vi ber om gyldige markedspriser på innrapporteringstidspunktet.
DMP vil fastsette pris ut fra skjønnsmessige vurderinger dersom man på forespørsel, og innenfor nærmere spesifiserte frister, ikke mottar de prisopplysningene fra legemiddelprodusenten som anses å være nødvendige for å kunne fastsette pris på legemiddelet i Norge.
Markedspris legges til grunn
DMP legger til grunn den reelle markedsprisen i hvert enkelt av landene som inngår i prissammenligningen. Med markedspris menes prisen størstedelen av markedet betaler for produktet.
Prisen fastsettes på AIP-nivå
Prisen som fastsettes av DMP, er den maksimale tillatte prisen til apotek (AIP – apotekenes innkjøpspris). Produktet kan fritt selges til en lavere pris enn maksimalprisen.
Valutakurser
Til grunn for prissammenligningen legges prisen i lokal valuta omregnet til norske kroner. Omregningen gjøres med siste seks måneders vekslingskurs, slik den presenteres av Norges Bank.
Revurdering
I henhold til legemiddelforskriftens § 12-5, kan både innehaver av markedsføringstillatelse og DMP ta opp spørsmålet om prisendring i Norge dersom endrede forhold eller nye opplysninger tilsier det.
Justeringene skal normalt ikke skje oftere enn årlig. Unntatt fra dette er prisen på nye produkter etter lansering. DMP kan da i toårsperioden etter lansering innhente nye prisopplysninger halvårlig fra den aktuelle legemiddelprodusenten for å fastsette pris i Norge.
Dersom et produkt trekkes fra ett av referanselandene, kan dette danne grunnlag for endring av pris i Norge. Man må fremlegge dokumentasjon for at et produkt faktisk er trukket fra markedet dersom dette skal danne grunnlag for prisendringer.
Sammenlignbare pakningsstørrelser
Pakningsstørrelser er ikke alltid direkte sammenlignbare. Prissammenligninger med andre land blir derfor foretatt på enhetsnivå. Dette innebærer at man sammenligner pris per tablett, pris per dose etc.
Ved prisfastsettelsen differensierer man som hovedregel mellom pris per enhetsnivå i store og små pakninger. En pakning med 30 eller færre enheter defineres normalt som liten. Pakninger med mer enn 30 enheter defineres som store.
For noen legemidler og legemiddelformer er det gjort unntak fra det normale pakningsskillet. Dette gjelder
- legemidler som benyttes i behandlingen av astmatiske lidelser defineres normalt en pakning med 120 eller færre doser som liten og en pakning med mer enn 120 doser som stor.
- enkelte legemidler mot erektil dysfunksjon og akutte anfall av migrene. Her defineres en pakning med 5 eller færre enheter som liten og en pakning med flere enheter som stor.
Injeksjonsvæske: generelt pakningsskille: 0 – 5 ml, 6 - 99 ml og 100 ml eller mer. Små pakninger av hetteglass, flaske, ampuller etc. sammenlignes per stk (med samme mengde/antall ml.) dersom det er t.o.m. 5 ml i hvert hetteglass, flaske, ampulle etc.
Infusjonsvæske: generelt pakningsskille: 0 – 5 ml, 6 ml - 1000 ml.
Pris per enhet i stor og liten pakning
I enkelte tilfeller kan man ved internasjonal prissammenligning, for en gitt styrke, få en lavere pris per enhet i en liten pakning sammenlignet med pris per enhet i en stor pakning. I disse tilfellene settes prisen per enhet i den store pakningen lik prisen per enhet i den lille pakningen. Dersom prisen per enhet er høyere i en liten pakning enn i en stor, aksepteres prisforskjellen dersom den ikke oppfattes som urimelig.
Prisforholdet mellom ulike styrker
Ved prisfastsettelsen vil DMP tilstrebe at prisforholdet mellom ulike styrker for ett gitt legemiddel står i et rimelig innbyrdes forhold. Det gjelder også når preparatene har ulike navn, men reelt sett er samme legemiddel.
Sammenlignbare legemidler
Ved fastsettelse av pris på et legemiddel i Norge vil man som hovedregel sammenligne med det samme produktet i referanselandene. Dersom et legemiddel markedsføres under ulike produktnavn i ulike referanseland, vil de likevel bli sammenlignet ved prisfastsettelsen. Også andre varianter av samme legemiddel vil kunne tas i betraktning ved prissammenligningen. Tablett, kapsel, smeltetablett, oppløselig tablett og brusetablett vil eksempelvis betraktes som varianter av samme legemiddel. Bare unntaksvis vil det fastsettes høyere pris for en annen variant av samme legemiddel.
Parallellimport
Legemidler som parallellimporteres til Norge gis pris begrenset oppad til den maksimale prisen på det direkteimporterte legemiddelet.
Generiske legemidler
I ATC-koder uten pakninger på trinnpris får generiske legemidler (med markedsføringstillatelse etter forenklet søknad1) laveste maksimale AIP av legemidler i samme ATC-kode, uavhengig av om søkegrunnlaget for disse legemidlene er biotilsvarende, bibliografisk eller original2.
I ATC-koder hvor det finnes pakninger på trinnpris, kan generiske legemidler få samme maksimalpriser som originalen.
For generiske legemidler trenger man ikke opplyse om priser fra andre land.
Biotilsvarende og bibliografiske legemidler
I ATC-koder uten pakninger på trinnpris får legemidler med markedsføringstillatelse etter søkegrunnlag som biotilsvarende3 eller bibliografisk4, maksimal AIP som er lavest av følgende:
- maksimal AIP beregnet etter 9-landsregelen for preparatet som prisfastsettes
- laveste maksimal AIP på legemidler i samme ATC-kode, uavhengig av om søkegrunnlaget for disse legemidlene er biotilsvarende, bibliografisk eller original
Prissøknad for biotilsvarende og bibliografiske legemidler må derfor inneholde prisopplysninger fra de ni referanselandene når det ikke finnes pakninger på trinnpris i ATC-koden.
For ATC-koder hvor det finnes pakninger på trinnpris kan biotilsvarende og bibliografiske preparater få samme maksimalpriser som originalen. For slike preparater er det ikke nødvendig å sende inn prisopplysninger fra referanselandene.
Unntak fra hovedreglene
I særlige tilfeller kan det være hensiktsmessig å fastsette en høyere maksimal AIP enn hovedreglene tilsier.
For at DMP i slike tilfeller skal avvike fra hovedreglene, må følgende to forutsetninger være tilstede:
- Det må være stor risiko for at legemiddelet ikke blir tilgjengelig i markedet hvis beregnet maksimalpris vedtas.
- Hvis legemiddelet ikke blir tilgjengelig, vil dette kunne ha negative konsekvenser for tilgangen til samfunnsnyttige og kostnadseffektive legemidler
Dersom disse forutsetningene er til stede, vil DMP vurdere å sette en høyere pris ut fra en skjønnsmessig vurdering. Da vil vi legge vekt på følgende forhold:
-
Dokumenterte produksjonskostnader
- Eventuelle særskilte forhold knyttet til beregningsgrunnlaget
Disse prinsippene vil også legges til grunn i tilfeller der trinnpriser beregnet forskriftsmessig blir svært lave.
Saksbehandlingstid
DMP har en frist på 90 dager til å behandle en søknad om pris, jf forskriftens § 12-6.
Referanser
- Forenklet søkegrunnlag: Direktiv 2001/83/EC art. 10 (1) generic application og 10 (3) hybrid application
-
Original: Direktiv 2001/83/EC art. 8 (3) full dossier, 10b fixed combination og 10c informed consent application
-
Biotilsvarende søkegrunnlag: Direktiv 2001/83/EC art. 10 (4) similar biological application
-
Bibliografisk søkegrunnlag: Direktiv 2001/83/EC art. 10a well-established use application
Oversikt over maksimalpriser
Oversikten inneholder prisopplysninger om alle reseptpliktige humanpreparater med varenummersom er tillatt markedsført i Norge.
På pakninger unntatt reseptplikt, uregistrerte legemidler og reseptfrie legemidler fremgår det ingen priser, da prisene på disse ikke er regulert.
Oversikten viser maksimal AIP (apotekenes innkjøpspris, ekskludert MVA) og maksimal AUP (apotekenes utsalgspris, inkludert MVA). Vær oppmerksom på at dette er maksimalpriser og at faktisk pris derfor kan være lavere enn oppgitt.
Helseforetakene oppnår som regel rabatter i sine innkjøp. Og myndighetene har inngått refusjonskontrakt med MT-innehaverne for Aimovig, Ajovy, Emgality, Aquipta, Ozempic og Rybelsus. Disse kontraktene innebærer at folketrygden refunderer legemidlene til rabatterte priser.
Problemer med å se Excel-dokument?
Dokumentet med oversikt over pakningspriser siden 2004 er så stort at DMPs nettløsning kan ha problemer med å vise innholdet direkte hvis du klikker på lenken nedenfor. Dette vil ofte være et problem i Edge, der dokumentet vises i Excel Online i stedet for at det lastes ned lokalt til PCen.
For å se innholdet i slike tilfeller, må du først laste ned dokumentet til PCen din før du åpner det. Du kan gjøre dette på to måter:
- Klikk på Last ned-knappen som vises i skjermbildet dersom du klikker på lenken til dokumentet.
- Høyreklikk på dokumentlenken og velg "Lagre kobling som".
Revurdering av maksimalpriser
Både innehaver av markedsføringstillatelse og DMP kan ta initiativ til en revurdering av prisene, men justeringer skal normalt ikke skje oftere enn en gang per år. DMP revurderer maksimalpris årlig for de mest omsatte virkestoffene. Hensikten med prisrevurdering er at maksimalprisene skal reflektere utviklingen i det europeiske prisbildet.
Når legemidler overføres fra refusjon på folketrygden til H-resept, og helseforetakene overtar finansieringsansvaret, opphører refusjonsprisbindinger som DMP tidligere har vedtatt.
-
Oversikt over revurderte priser gyldig fra 01.10.2025 (Excel)
- Preparater det vil bli forespurt prisopplysninger på i oktober 2025 (Excel)
I henhold til våre retningslinjer kan MT-innehaver søke om ny maksimalpris dersom det er gått mer enn 1 år siden preparatene sist fikk pris.
Praktiske rutiner ved årlig revurdering av maksimalpriser
Saksgang
Både innehaver av markedsføringstillatelse og DMP kan ta initiativ til en revurdering av prisene, men justeringer skal normalt ikke skje oftere enn en gang per år. DMP revurderer maksimalpris årlig for de mest omsatte virkestoffene. Hensikten med prisrevurdering er at maksimalprisene skal reflektere utviklingen i det europeiske prisbildet.
Når legemidler overføres fra refusjon på folketrygden til H-resept, og helseforetakene overtar finansieringsansvaret, opphører refusjonsprisbindinger som DMP tidligere har vedtatt.
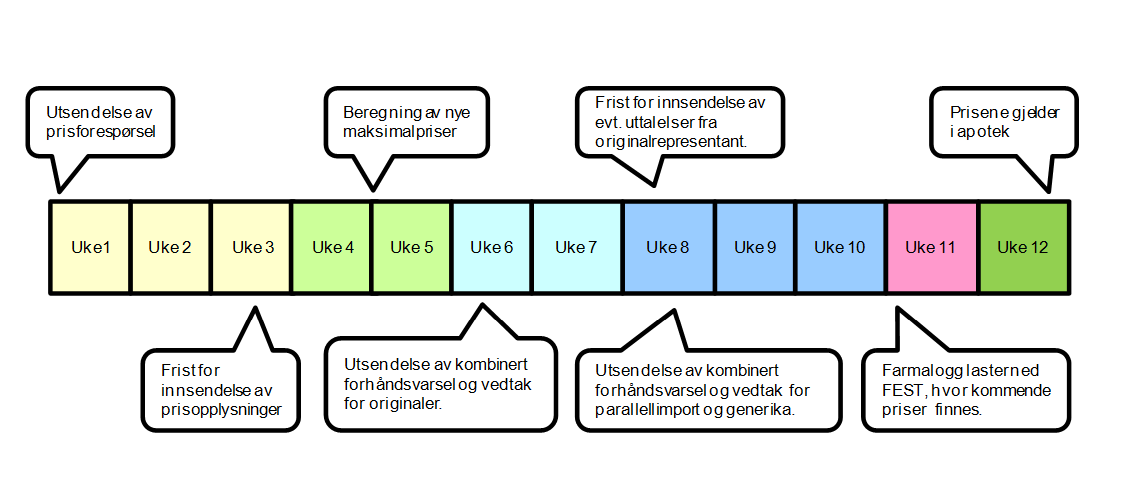
Direktoratet for medisinske produkter initierer prisrevurderingen ved å sende ut prisforespørsel til originalrepresentanten. Denne får tre ukers frist til å sende inn de forespurte prisopplysningene.
Når prisopplysningene er mottatt, beregner DMP ny maksimal AIP på grunnlag av de innkommende prisopplysningene, legemiddelforskriftens kapittel 12 og DMPs retningslinjer for prisfastsettelse. Dersom ønskede prisopplysninger ikke foreligger innen tre uker eller de innsendte prisopplysningene er mangelfulle, vil DMP fastsette maksimal AIP ut fra en skjønnsmessig vurdering. Prisen forhåndsvarsles med et kombinert forhåndsvarsel og vedtaksbrev, som går til originalrepresentanten med to ukers uttalelsesfrist. Dette brevet vil inkludere det faktiske grunnlaget for den nye maksimalprisen.
Under forutsetning av at Direktoratet for medisinske produkter ikke mottar uttalelse i saken innen gitt frist, trer vedtaket i kraft ved uttalelsesfristens utløp med de nye maksimale AIP for den enkelte pakning som fremgår av det medfølgende vedlegget. Originalrepresentanten har en klagefrist på tre uker fra vedtaket er fattet. Dette gjelder uansett om det har blitt utferdiget et eget vedtaksbrev eller ikke. De nye maksimalprisene vil først gjelde i apotek cirka fire uker etter at de er vedtatt (den 1. i måneden).
Etter at vedtak for originalen er fattet, sendes et tilsvarende kombinert forhåndsvarsel og vedtaksbrev med nye maksimalpriser til eventuelle parallellimportører (PI) og generikarepresentanter. Deretter følger samme saksgang som for originalen, med unntak av at prisen vil være gjeldene i apotek cirka to uker fra den datoen de er vedtatt (den 1. i måneden). Dette betyr at de nye maksimalprisene for hele virkestoffet vil gjelde fra samme dato.
Informasjon om nye maksimalpriser nedlastes via FEST av Farmalogg AS for implementering av de nye maksimalprisene i apotek.
Revurderingsrekkefølgen
Ved månedsskiftet august/september hvert år offentliggjør DMP revurderingsrekkefølgen for kommende år.
Hvilke virkestoff og i hvilken rekkefølge de blir revurdert bestemmer vi ut fra følgende kriterier:
-
Via Farmalogg legemiddelstatistikk finner vi de mest omsatte virkestoffene (5.ATC-nivå) de siste 12 måneder.
-
Veterinære legemidler, uregistrerte legemidler, reseptfrie legemidler samt pakninger unntatt reseptplikt tas ut av omsetningen før rangering.
-
Virkestoffgruppene (1.ATC-nivå) rangeres etter AUP-omsetning (synkende).
-
Deretter rangeres de ulike virkestoffgruppene terapeutisk (2.ATC-nivå) etter AUP-omsetning (synkende).
-
Noen virkestoff med liten omsetning velges ut på grunnlag av at de enten har vokst mye de siste to årene eller er spesielt dyre.
Når prisrevurderingsrekkefølgen fremstilles på denne måten, kan det variere fra år til år i hvilken måned et virkestoff revurderes. Det kan derfor oppstå tilfeller hvor legemidler revurderes med mer eller mindre enn ett års mellomrom. For å sikre at legemidler innen samme terapeutiske område prisrevurderes samtidig, vil det imidlertid ikke være anledning til å fravike revurderingsrekkefølgen. ATC-kodene er fordelt over perioden januar til desember.
Revurderingsrekkefølge
Søknad om maksimalpris
Reseptpliktige legemidler for mennesker må ha en maksimalpris for å kunne markedsføres. Innehaver av markedsføringstillatelse (MT) må søke Direktoratet for medisinske produkter om pris.
MT-innehaver må sende inn en ny prissøknad hvis man ønsker å markedsføre en ny legemiddelform, styrke eller pakning av et legemiddel som allerede har pris. Alle pakningene må revurderes dersom det er gått mer enn ett år siden legemiddelet sist fikk pris. DMP vil kunne gjøre unntak fra dette i forbindelse med prisfastsettelse på nye formuleringer beregnet til barn.
Det er ikke behov for prissøknad ved varenummerbytte på en pakning som allerede har godkjent maksimalpris.
Skjema og innsending
Ved prissøknad og prisrevurdering benytter Direktoratet for medisinske produkter samme skjema
Det skal benyttes ett prissøknadsskjema for hver form av legemiddelet.
Skjemaet består av to ark:
-
Legemiddelfakta - faktaopplysninger om legemiddelet og pakningene fylles inn
-
Prisopplysninger - prisopplysninger for legemiddelet fylles inn
Prisopplysninger
-
Skal oppgis for bibliografiske og biotilsvarende legemidler.
-
Skal ikke oppgis dersom det er mindre enn ett år siden maksimalprisen på legemiddelet ble fastsatt (gjelder pakninger med samme legemiddelform, styrke og størrelsesgruppe).
-
Skal ikke oppgis for generiske og parallellimporterte legemidler.
Søknaden sendes til: prisinformasjon@dmp.no
Saksbehandlingstid
I 2. kvartal 2025 ble 66% av søknadene behandlet innen 50 dager. Forrige kvartal var resultatet 46%. Den gjennomsnittlige saksbehandlingstiden er 43 dager mot 54 dager i forrige kvartal.
Ordforklaringer
Farmastat: Database som inneholder legemiddelstatistikk for det norske markedet.
ATC: Anatomical Therapeutic Chemical Classification System, på norsk: Anatomisk terapeutisk kjemisk legemiddelregister. For en mer detaljert beskrivelse av systemet: www.whocc.no
EØS: Det europeiske økonomiske samarbeidsområde.