Eudamed
Publisert:
Endringer
- : Spesifisert rekkefølgen modulene blir tilgjengelig i
- : EUDAMED: Fjernet detaljer omkring ny tidslinje. Omorganisert noe informasjon.
Europeiske databasen for medisinsk utstyr (Eudamed) er en av de viktigste aspektene i de nye forordningene for medisinsk utstyr.
Innhold på siden
Hva er eudamed
Eudamed vil gi en oversikt over livssyklusen til medisinsk utstyr som er tilgjengelig på markedet i EU. Hensikten er å øke åpenheten generelt, blant annet ved å gi bedre tilgang til informasjon for allmennheten og helsepersonell, samt forbedre samarbeidet mellom ulike EU-land.
Eudamed vil bestå av følgende seks moduler:
- Aktørregister
- Produktregistrering og unik produktidentifikasjon (UDI)
- Meldte organer og sertifikater
- Kliniske utprøvning og ytelsesstudier
- Sikkerhetsovervåking
- Markedsovervåkning.
Registrering i eudamed
Eudamed er ennå ikke obligatorisk å bruke. Frem til Eudamed er obligatorisk å bruke vil en del av kravene i MDR og IVDR bortfalle. Kravene i forskrift om medisinsk utstyr § 24(Ekstern lenke) vil gjelde som en overgangsordning.
DMP oppfordrer norske produsenter, autoriserte representanter, importører og sammensettere av systemer og prosedyresett til å registrere seg også før registreringsplikten blir obligatorisk. Frivillig registrering i Eudamed erstatter ikke registreringsplikten i Utstyrsregisteret.
Følgende aktører kan registrere seg i Eudamed
-
Produsenter
-
Autoriserte representanter
-
Importører
-
Sammensettere av systemer og prosedyresett
Hvordan registrere seg i Eudamed
Produsenter, autoriserte representanter og importører av medisinsk utstyr kan registrere seg og sitt utstyr. For mer informasjon om registreringsprosessen i Eudamed
Det er aktørenes ansvar å sørge for at informasjonen i Eudamed til enhver tid holdes oppdatert.
Du finner mer informasjon om Eudamed på EU-kommisjonens nettsider.
Oversikt over de ulike rollene for markedsdeltakere
| Markedsdeltaker | Definisjon i MDR artikkel 2 og IVDR artikkel 2 |
|---|---|
| Produsent | en fysisk eller juridisk person som framstiller eller helrenoverer utstyr, eller som får utstyr designet, framstilt eller helrenovert, og som markedsfører nevnte utstyr i eget navn eller under eget varemerke. |
| Autorisert representant | enhver fysisk eller juridisk person etablert i Unionen* som har fått og har akseptert en skriftlig fullmakt fra en produsent plassert utenfor Unionen, til å utføre bestemte oppgaver på dennes vegne med hensyn til dennes forpliktelser i henhold til denne forordning. |
| Importør | enhver fysisk eller juridisk person etablert i Unionen* som bringer utstyr fra en tredjestat i omsetning i Unionen*. |
| Distributør | enhver fysisk eller juridisk person i omsetningskjeden, utenom produsenten eller importøren, som gjør utstyr tilgjengelig på markedet fram til ibruktaking. |
| Helseinstitusjon | en organisasjon som har som hovedformål å pleie eller behandle pasienter eller fremme folkehelsen. |
* Med «Unionen» menes her EU/EØS-området og Tyrkia.
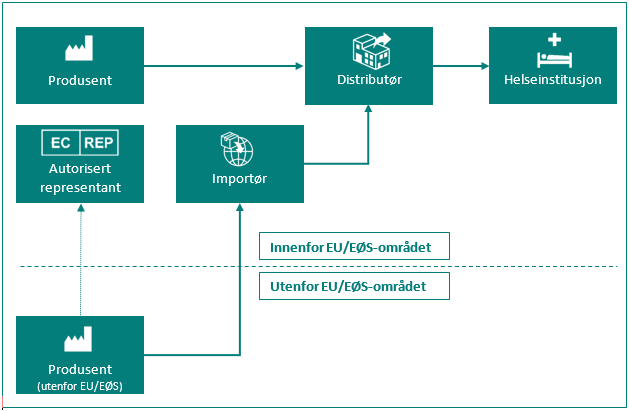
Figur: Markedsdeltaker i omsetningskjeden.
Når blir Eudamed obligatorisk?
Eudamed vil lanseres trinnvis, og de tre modulene for registrering av aktører, utstyr og sertifikater er først ut. Når de har passert en uavhengig revisjon vil EU-kommisjonen komme med en publikasjon, og 6 måneder etter dette vil disse modulene bli obligatorisk å bruke.
Introduksjon av Eudamed krever mange forberedelser. For mer informasjon om fremdrift i prosjektet og hvordan du som aktør kan gjøre deg klar, se Eudamed information center
I juni 2024 ble ny tidslinje for Eudamed publisert på den europeiske kommisjonens offisielle nettsted.
DMP vil informere når det kommer ytterligere oppdateringer.