Bivirkningsregisteret
Publisert:
|
Oppdatert:
Endringer
Bivirkningsregisteret inneholder meldinger om mistenkte bivirkninger av legemidler fra helsepersonell, pasienter og pårørende i Norge.
Innhold på siden
Bivirkningsregisteret skal bidra til sikker og effektiv legemiddelbruk; gjennom fortløpende og systematisk samle, behandle og analysere opplysninger i bivirkningsmeldinger.
Hensikten med bivirkningsregisteret er å ivareta pasientsikkerheten ved å:
- Avdekke mistanke om uventede, nye eller alvorlige bivirkninger så raskt som mulig
- Bidra til å etablere årsakssammenheng mellom legemiddel og mulig bivirkning.
- Identifisere risikogrupper for bivirkninger
Helsepersonell kan melde bivirkninger uten samtykke fra pasienten. De regionale legemiddelinformasjonssentrene (RELIS) og Folkehelseinstituttet (for vaksiner) behandler meldinger fra helsepersonell og gir tilbakemelding til melder. DMP behandler bivirkningsmeldinger fra pasienter, og er samtidig ansvarlig for hele registeret.
Hva er en bivirkning?
En bivirkning er en skadelig og utilsiktet virkning av et legemiddel. Dette gjelder uavhengig av om legemiddelet er brukt som beskrevet produktinformasjonen.
Definisjonen omfatter også skadelig og utilsiktet virkning ved:
- overdose
- feilbruk
- misbruk
- medisineringsfeil
- feildosering
- behandling utenfor godkjent bruksområde
- yrkeseksponering
Hvordan meldes bivirkninger til bivirkningsregisteret?
Bivirkningsmeldinger kan sendes av helsepersonell, pasienter, pårørende og legemiddelfirma. Nasjonale helseregistre, som Bivirkningsregisteret, er lovbestemte og landsdekkende register, og helsepersonell har meldeplikt til registrene. Bivirkninger meldes ved mistanke; det vil si at den som melder mener det kan være sammenheng mellom bruk av et eller flere legemidler og en hendelse som oppstår (antatt bivirkning). Det er ikke krav om at en slik sammenheng er bevist.
Les mer om meldeordningene:
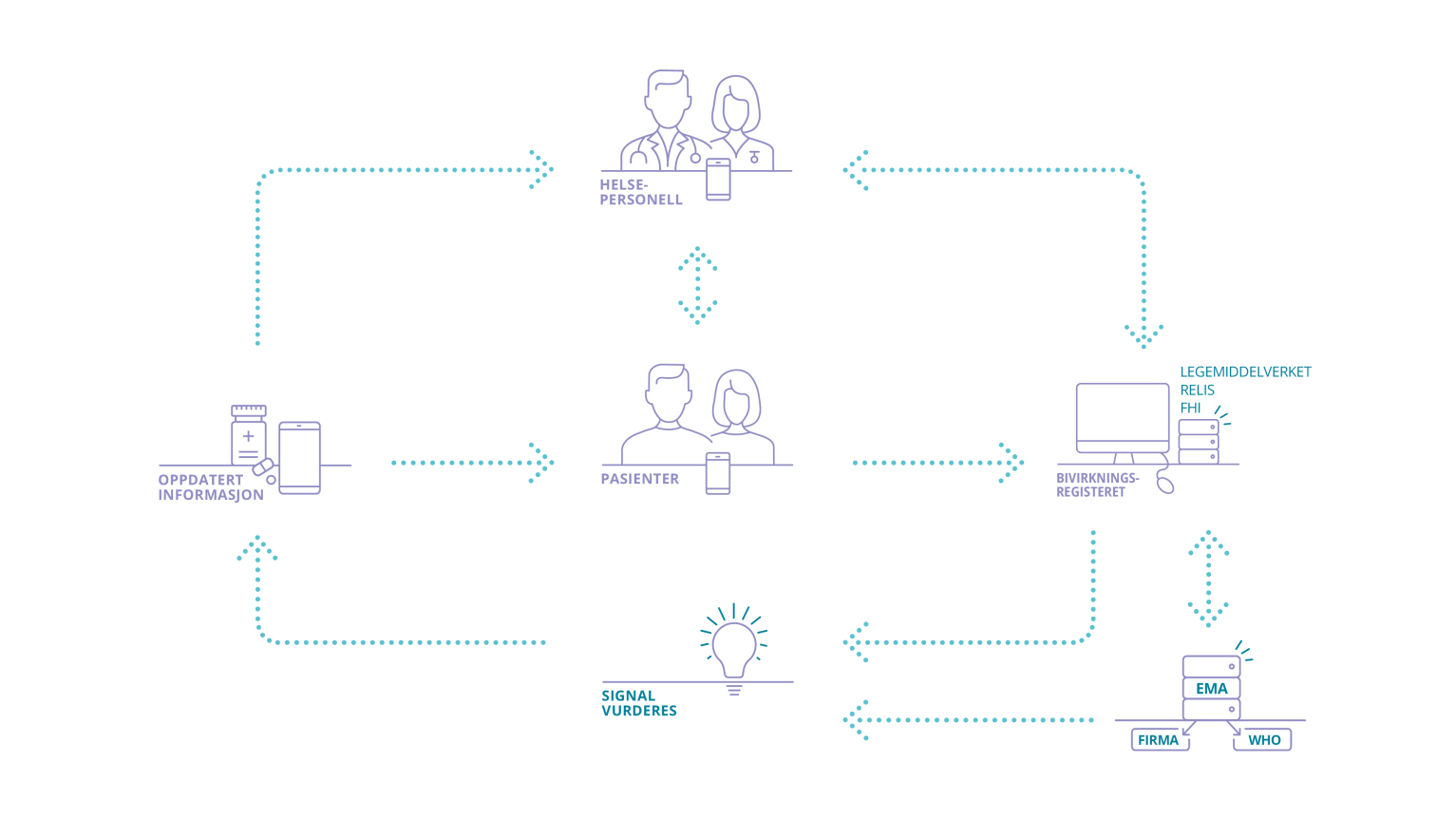
MELDESYSTEMET FOR BIVIRKNINGER: Helsepersonell og pasienter/privatpersoner kan melde inn bivirkninger til Bivirkningsregisteret. Bivirkningsmeldingene deles (anonymisert) med EMA, WHO og legemiddelfirmaene som alle overvåker legemidlene på markedet.
Hva gjør DMP med bivirkningsmeldingene?
Informasjonen fra Bivirkningsregisteret inngår i den fortløpende nytte-risikovurderingen som gjøres for alle legemidler. DMP er ansvarlige for dataene og bruker disse i sin løpende overvåking av alle legemidler som brukes i Norge. Les mer om legemiddelovervåking.
Behandlingen av meldingene i registeret er todelt. Dataene behandles først på individnivå, deretter i større analyser på populasjonsnivå.
Individnivå
Bivirkningsmeldingene blir saksbehandlet av bivirkningssentrene (RELIS, Folkehelseinstituttet eller DMP). Dette innebærer at meldingen blir kodet etter internasjonale kodeverk, slik at symptomer, sykdommer og legemidler gis et internasjonalt standardisert format. Kodingen er viktig for å kunne søke etter nye bivirkningssignaler på tvers av landegrenser. I tillegg beskrives hendelsen i fritekst.
For bivirkningsmeldinger fra helsepersonell gjør bivirkningssentrene en vurdering av hvor sannsynlig sammenhengen mellom legemiddelbruk og bivirkning er. Vurderingen gjøres ved hjelp av en skala utviklet av Verdens helseorganisasjon (WHO), men er også basert på kunnskap om legemiddelet, for eksempel produktinformasjonen og vitenskapelige studier. Vurderingen er også bygget på opplysningene om pasient og bivirkning i meldingen. Vurdering av mulig sammenheng mellom legemiddelbruk og bivirkninger kan endre seg over tid, dersom kunnskapen om legemiddelet øker.
Helsepersonell som har meldt en bivirkning får en tilbakemelding der årsakssammenhengen er vurdert. Det blir ikke gitt individuell tilbakemelding til pasienter eller pårørende som melder selv.
Populasjonsnivå
DMP videreformidler fortløpende bivirkningsmeldinger, uten identitetsopplysninger, til Det europeiske legemiddelkontoret (EMA). EMA sikrer at bivirkningsinformasjonen oversendes til WHO sin verdensomspennende bivirkningsdatabase. Legemiddelfirma får tilgang til informasjon om bivirkningsmeldinger for egne legemidler fra EMAs database.
DMP, EMA, WHO og legemiddelfirmaene gjør fortløpende analyser av sine bivirkningsdata. Dette kalles signaldeteksjon og består av både statistiske beregninger og gjennomgang av data for å avdekke ukjente bivirkninger. Når det avdekkes et signal gjøres det en grundigere analyse for å vurdere om det kan være en ny bivirkning av legemiddelet, eller om det er andre faktorer som kan forklare signalet. På grunnlag av disse analysene vil det være aktuelt å oppdatere legemiddelinformasjonen med nye bivirkninger eller innføre tiltak for å minimere risikoen. I de alvorligste tilfellene kan det være aktuelt å trekke legemiddelet fra markedet.
I tillegg til signaler om nye bivirkninger gir informasjonen i databasen et bilde av hvilke typer bivirkninger som oppstår ved legemiddelbruk og, for eksempel, hvordan bivirkninger fordeler seg på kjønn og alder.
Til hvilke formål kan bivirkningsdata gjøres tilgjengelig?
- DMP benytter bivirkningsdata i sin løpende overvåking av alle legemidler som brukes i Norge.
- Bivirkningsdata kan også gjøres tilgjengelig for andre for styring, planlegging og kvalitetsforbedring av legemidler og legemiddelbruk, samt til forskning.
- Registeret er et nasjonalt helseregister som kan kobles med data fra andre registre.
Hva er bivirkningsdataenes begrensninger?
Bivirkningsregisteret er ikke en systematisk oversikt over alle bivirkninger som oppstår. Derfor kan det ofte ikke konkluderes med sikkerhet at det aktuelle legemiddelet er årsak til den meldte bivirkningen, eller at legemiddelet er utrygt å bruke.
Rapportering av legemiddelbivirkninger ved vanlig bruk (klinisk praksis) kalles ofte spontanrapportering. Bivirkningsregisteret mottar spontane meldinger fra helsepersonell og pasienter, men også fra legemiddelprodusentene (innehavere av markedsføringstillatelser). Meldingene fra produsentene inneholder ikke fødselsnummer.
Bivirkningsregisteret omfatter ikke bivirkninger fra kliniske studier (utprøvning av legemidler). Disse ivaretas av andre systemer.
Rapportering av bivirkninger kan påvirkes av mange faktorer, for eksempel omfanget av bruk, hvor enkelt det er å gjenkjenne bivirkningen og forhold rundt sykdomstilstanden. Spontanrapporter må derfor tolkes med varsomhet: Meldingene kan ikke brukes til å beregne frekvensen av bivirkninger, fordi det er en ukjent andel av hendelsene som meldes. Det finnes heller ikke alltid informasjon om det totale antallet pasienter som har brukt legemiddelet, så sammenligninger mellom ulike legemidler basert på spontanrapporter kan være misvisende.
Balansen mellom nytte og risiko for et spesifikt legemiddel varierer mellom pasienter. Vurderingen av nytten mot risikoen krever alltid detaljert utredning og vitenskapelig analyse av alle tilgjengelige data. Bivirkningsmeldingene inngår i denne vurderingen sammen med informasjon fra andre kilder. Myndighetene gjør nytte-risikovurderinger på befolkningsnivå, mens lege og pasient i fellesskap gjør denne vurderingen på individnivå.
Hva med data før Bivirkningsregisteret?
Bivirkningsdata er samlet inn i Norge siden 1971. Fra 1971 til og med 2019 registrerte man ikke fødselsnummer med meldingene. Det betyr at data fra denne perioden ikke kan sammenstilles med andre helseregistre, men dataene er tilgjengelige og søkbare som avidentifiserte opplysninger hos DMP.
Hvorfor er fødselsnummer nødvendig?
Fødselsnummer brukes for å knytte informasjon fra ulike kilder eller deler av forløp til én person (sammenstilling av ulike datakilder). Bivirkningsmeldingene får økt informasjonsverdi, fordi de kan deles og berikes med data fra andre registre. Slike sammenstillinger er av stor nytte for å studere bivirkninger nærmere og bidrar til å øke pasientsikkerheten.
Fødselsnummer separeres fra øvrige opplysninger og krypteres før behandling. De er ikke tilgjengelig i ordinær bruk av registeropplysningene eller etter kobling med data fra andre helseregistre. I bivirkningsregisteret oppbevares ikke den registrertes navn, adresse eller fødselsnummer sammen med opplysningene om legemiddelbruken og bivirkningen. For bivirkninger meldt før bivirkningsregisterforskriften trådte i kraft, 1. januar 2020, er fødselsnummer ikke registrert.
Det vil mangle fødselsnummer for en andel av meldingene i Bivirkningsregisteret som det ikke vil være mulig å sammenstille med andre registre:
- Legemiddelprodusentene melder bivirkninger til DMP uten fødselsnummer.
- Meldinger direkte fra pasienter og pårørende i første del av 2020, siden denne funksjonaliteten ikke er på plass i meldeskjemaet enda.
- Elektroniske meldinger fra helsepersonell fra 1.1.2020 til 30.4.2020, da det ikke var mulig å melde med fødselsnummer.
- DMP registrerer ellers bivirkningsmeldinger der fødselsnummer av ulike årsaker mangler.
Hvordan ivaretas personvern og informasjonssikkerhet?
Det er strenge krav til personvern og informasjonssikkerhet for Bivirkningsregisteret.
Les mer om dette i vår personvernerklæring.
For å bevare pasientens personvern, er allmennhetens tilgang til bivirkningsinformasjon kun på aggregert nivå i form av statistikk.
Hvilke rettigheter har du hvis du er oppført i Bivirkningsregisteret?
Den som er registrert i bivirkningsregisteret har rett til informasjon og innsyn i egne opplysninger. Den registrerte har også rett til innsyn i hvem som har hatt tilgang til eller fått utlevert helseopplysninger knyttet til eget navn eller fødselsnummer. Den registrerte i Bivirkningsregisteret kan også motsette seg at helseopplysninger gjøres tilgjengelig for bruk utover hovedformålet.
Les mer i vår personvernerklæring og i Bivirkningsregisterforskriften §§2-2, 4-1, 4-2 og 4-3.
Hvor lenge lagres bivirkningsdata?
Bivirkningsdata kan lagres i ubestemt tid (Bivirkningsregisterforskriften § 4-7) Bakgrunnen for dette er at bivirkningsdata må være tilgjengelig så lenge virkestoffet er på markedet. Virkestoff som tidligere har vært på markedet kan også komme tilbake i klinisk bruk.